
|
Homone |
Autor: Hans Trachsel |
last update: 25. Januar 1999 |
GH-RH (growth hormon releasing hormone) ist ein 44 Aminosäuren langes Peptid. Es wurde erstmals 1982 in reiner Form dargestellt, allerdings nicht aus Hypothalamusgewebe, sondern aus Tumoren des Pankreas von Patienten, welche an Akromegalie litten. Diese Tumoren produzierten eine Substanz, welche die Hypophysen der Patienten zur Produktion von übermässig viel Wachstumshormon anregte. GH-RH interagiert mit einem Rezeptor auf somatotropen Zellen des Hypophysenvorderlappens. Aktivierter Rezeptor bewirkt Erhöhung der cAMP-Konzentration, Aktivierung von Proteinkinase A und die Synthese und Entlassung von Wachstumshormon aus der Zelle.
Der Rezeptor ist 620 Aminosäuren lang und ist ein Glycoprotein mit einem Molekulargewicht von 130kD. Er wurde 1987 identifiziert und sein Gen kloniert. Bindung von Wachstumshormon führt zu Dimerisierung und damit Aktivierung des Rezeptors. Details der Signaltransduktion sind nicht bekannt.
IGF's ( insulin-like growth factors) wurden früher Somatomedine genannt. Sie sind ca. 70 Aminosäuren lange Peptide. Diese Wachstumsfaktoren sind im Serum etwa 1000-fach konzentrierter als Insulin, werden an IGF-Bindungsproteine (6 sind z.Z. bekannt) gebunden transportiert und von fast allen Zellen für optimales Wachstum benötigt. Sie reagieren an Zielzellen mit Oberflächenrezeptoren, welche ebenfalls (wenn auch weniger gut) mit Insulin reagieren können.
Mangel an Wachstumshormon während der Kindheit führt zu hypophysärem Zwergwuchs (Häufigkeit: 1 von ca. 5000 Kindern). Diese Abnormalität kann durch Hormon-Gabe korrigiert werden. Es gibt aber auch Formen des Zwergwuchses, bei denen die Wachstumshormon-Spiegel normal oder gar erhöht sind. In einer untersuchten Form (Laron-Zwerge) werden wenig bis keine IGF synthetisiert, weil Leberzellen bedingt durch einen Rezeptor-Defekt nicht auf Wachstumshormon ansprechen. Bei Pygmäen wurde ebenfalls eine Störung der IGF-Produktion festgestellt.
Eine Reihe von weiteren Faktoren wie Mangelernährung kann zu Wachstumsverzögerungen führen.
Riesenwuchs resultiert aus zu hohen Wachstumshormonspiegeln während der Kindheit. Sie sind meist durch Hypohysentumoren bedingt. In solchen Fällen ist auch die Produktion anderer Hypophysen-Hormone beeinträchtigt. Falls die Gonadotropin-Produktion erniedrigt ist kommt es zusätzlich zu einer Verzögerung der Pubertät und damit einer Verlängerung der Wachstumsphase.
Einer der grössten bekannten Menschen wurde 2,72m gross und 215kg schwer (Robert Wadlow, geb. 1928, USA). Er hatte einen Hypophysentumor, welcher schon kurz nach der Geburt hohe Mengen Wachstumshormon produzierte. Schon als Einjähriger war Robert Wadlow 1,12m gross und wog 28kg. Im Alter von 9 Jahren mass er 1,85m und wog 81kg. Er machte keine Pubertät durch und wuchs ständig weiter. Im Alter von 22 Jahren starb er an einer Infektion.
Beim Erwachsenen führen zu hohe Wachstumshormon-Spiegel zu "Wucherungen" (lokales Wachstum) von Weichteilen, Knochen und Knorpeln (Kinn, Nase, Hände, Füsse). Häufiger Grund für diese Krankheit sind Hypophysen-Tumoren.
Das Vorläuferprotein Preproopiomelanocortin (285 Aminosäuren lang) wird in Zellen des HVL ins ER synthetisiert und auf seinem Weg vom Golgi zur Zelloberfläche in Vesikeln von Proteasen an spezifischen Stellen (Fig. 6) gespalten. Verschiedene Zelltypen des HVL spalten dabei das Molekül auf unterschiedliche Art, was zur Bildung verschiedener aktiver Peptide vom gleichen Vorläuferprotein führt.

Fig. 6: Preproopiomelanocortin und seine Spaltprodukte
Die Synthese geht von Cholesterin aus (Fig. 8, dicke Pfeile). Das Vorhandensein und die Aktivitäten der verschiedenen Enzyme bestimmen, welche Syntheseschritte eine Zelle durchführen kann. Der geschwindigkeitsbestimmende Schritt ist die Abspaltung des C22-C27 Fragmentes durch das Enzym Desmolase. Dieses Enzym wird durch Corticotropin aktiviert.
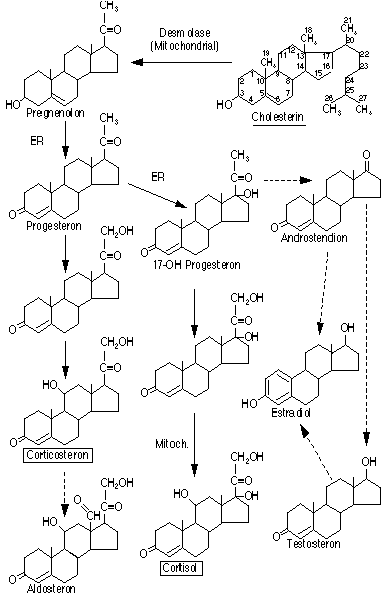
Fig. 8: Steroidhormon-Synthese
Lipocortin: Glucocorticoide induzieren die Synthese von Lipocortinen. Diese Eiweisse hemmen Phospholipase A2, welche aus Phospholipiden Arachidonsäure freisetzt. Damit wird die Konzentration der Ausgangssubstanz zur Synthese von Prostaglandinen und Leukotrienen und die Synthese dieser potenten Gewebehormone herabgesetzt. Bei entzündlichen Reaktionen werden erhöhte Mengen dieser Gewebehormone gemacht.
Expression von Oberflächenproteinen: Glucocorticoide hemmen die Expression von Oberflächenproteinen auf Endothelzellen, welche die Anlagerung von Lymphozyten und den Austritt dieser Zellen aus der Blutbahn ins Gewebe ermöglichen. Dieser Austritt ist bei Entzündungen sehr wichtig.
Das Gen für Adiuretin codiert ein Vorstufenprotein (Prepro-Adiuretin), welches proteolytisch in Adiuretin, das Trägerprotein Neurophysin II und einen Glycoproteinteil gespalten wird (Fig. 10). Neurophysin II dient als Transportprotein für Adiuretin. Die Funktion des Gycoproteinanteils ist nicht bekannt.

Fig. 10: Prepro-Adiuretin (Vasopressin)
Die Synthese geht von Cholesterin aus (Fig. 11, dicke Pfeile). Der geschwindigkeitsbestimmende Schritt ist die Abspaltung des C22-C27 Fragmentes durch das Enzym Desmolase.

Fig. 11: Aldosteron-Synthese
Die Protease Renin aus der Niere (40kD Protein) spaltet vom Serumprotein Angiotensinogen (in der Leber synthetisiert) das Peptid Angiotensin I (10 Aminosäuren) ab. Angiotensin I wird durch die Serumprotease angiotensin converting enzyme in Angiotensin II (8 Aminosäuren) überführt. Neben seinem Effekt auf die Nebennierenrinde stimuliert Angiotensin II direkt die Vasoconstriction und Durstgefühl.
Die Aldosteronrezeptoren aktivieren die Transkription neuer Gene. Unter ihnen ist auch das Gen für die Citratsynthetase. Das führt zur Stimulation des Krebszyklus in den Mitochondrien der Zielzellen und vermehrter ATP-Synthese. Erhöhte ATP-Spiegel stimulieren die ATP-abhängigen Na-Kanäle und damit die Na-Rückresorption.
In der Haut wird unter UV-Bestrahlung aus 7-Dehydrocholesterin Vitamin D3 ("Provitamin") gebildet. Diese Form hat nur geringe Aktivität. Vitamin D3 wird in der Leber am C25 und in der Niere am C1 hydroxyliert (Fig. 13). Die Hydroxylierung am C1 wird durch Parathormon reguliert, indem dieses Hormon die Synthese der mitochondrialen Hydroxylase in Zellen der Nierentubuli stimuliert.

Fig. 13: Biosynthese von 1, 25-Dihydroxyvitamin D3
Zellen der Nebenschilddrüsen exprimieren Rezeptoren (1085 Aminosäuren lang, Membranproteine, welche 7x die Membran durchqueren), welche Ca++ binden und über Aktivierung des Phosphoinositol-Signaltransduktionsweges die Sekretion von Parathormon regulieren. Anstieg des extrazellulären Ca++ resultiert in Rezeptor-Aktivierung, Anstieg des intrazellulären Ca++ und Hemmung der Ausschüttung von Parathormon.
Die einzelnen Schritte der Biosynthese sind in der Fig. 15 dargestellt:

Fig. 15: Biosynthese von Adrenalin
Die Aminosäure L-Tyrosin wird durch die Tyrosinhydroxylase hydroxyliert (Schritt 1). Dies ist der limitierende Schritt der Biosynthese. Er wird durch Adrenalin inhibiert (negative feed-back Regulation). Das Enzym enthält Fe++ und braucht den Cofaktor Tetrahydropteridin als Elektronendonor für die Reduktion von Sauerstoff in der Reaktion. Das Produkt der Reaktion ist L-Dopa (Dihydroxyphenylalanin). L-Dopa wird durch die Dopa-Decarboxylase zu Dopamin decarboxyliert (Schritt 2). Cofaktor in dieser Reaktion ist Pyridoxalphosphat. Dopamin wird zu L-Noradrenalin hydroxyliert (Schritt 3). Ascorbinsäure ist der Elektronendonor zur Reduktion von Sauerstoff in dieser Reaktion. Noradrenalin wird durch Methylierung (Schritt 4) mittels Phenyläthanolamin-N- Methyltransferase in L-Adrenalin übergeführt. Cofaktor ist S-Adenosylmethionin. Dieser letzte Schritt findet nur im Nebennierenmark, nicht aber in Nervenzellen statt. Die Synthese des Enzyms wird durch Cortisol reguliert.
Adrenalin interagiert mit zwei unterschiedlichen Rezeptor-Typen, a- und b-Rezeptoren. Noradrenalin dagegen interagiert vorwiegend mit a-Rezeptoren. b-Rezeptoren haben strukturelle Aehnlichkeit mit Rhodopsin. Aktivierung eines b-Rezeptors hat erhöhte Synthese von cAMP und Aktivierung der Proteinkinase A in Zielzellen zur Folge. a-Rezeptoren aktivieren wahrscheinlich den Phosphoinositol-Signaltransduktionsweg. In gewissen Organen haben Aktivierung von a- und b-Rezeptoren entgegegesetzte Wirkungen zur Folge, z.B. Kontraktion (a) und Erschlaffung (b) der Gefässmuskulatur. Somit ist die Art der Rezeptoren, welche ein Organ für Adrenalin hat, für die möglichen Reaktionen von Bedeutung.
Wie für andere Peptidhormone wird zuerst ein Vorstufenprotein ins ER synthetisiert (Praeproinsulin). Dieses wird durch S-S-Brücken stabilisiert. Daraus wird im Golgi-Apparat ein internes Stück (C-Peptid) herausgeschnitten. Es entstehen 2 Ketten, welche über S-S-Brücken zusammengehalten werden (Fig. 17). Insulin und C-Peptid werden in Vesikeln (b-Granula) aufbewahrt und nach Stimulus zusammen entlassen. Eine Funktion für das C-Peptid ist bisher nicht bekannt.

Fig. 17: Synthese und Struktur von Insulin
Der Rezeptor besteht aus vier Polypeptid-Ketten, von denen je zwei identisch sind (a2b2). Die b-Ketten durchdringen die Zellmembran. Sie haben die a-Ketten über S-S-Brücken extrazellulär gebunden. Die Bindung von Insulin an die a-Ketten induziert die Phosphorylierung der b-Ketten an Tyrosin-Resten in deren intrazellulären Domänen. Dies führt zur Anlagerung und Aktivierung einer Reihe von Proteinen und zum GDP-GTP-Austausch am G-Protein Ras. Aktiviertes Ras aktiviert seinerseits eine Proteinkinase-Kaskade. Diese Kinasen bewirken direkt oder über weitere Signalmoleküle Veränderungen in der Zielzelle. Aktivierung des Rezeptors führt zu Erniedrigung von cAMP über Hemmung der Adenylatcyclase und Stimulierung der Phosphodiesterase. Insulin-Rezeptorkomplexe werden danach von der Zielzelle aufgenommen (Endocytose), Insulin in Lysosomen degradiert und die Rezeptoren an die Zelloberfläche rezykliert.
Glucose-Transporter sind Membranproteine, welche den Durchtritt von Glucose durch Membranen ermöglichen. Es handelt sich um etwa 500 Aminosäuren lange Proteine, die 12 membran-spannende Segmente besitzen und so einen "Kanal" in der Membran bilden. Mehrere unterschiedliche Typen sind bekannt. Von grosser Bedeutung ist der Befund, dass gewisse Typen (z.B. Typ 2) konstitutiv in die Zellmembran eingelagert werden, während andere Typen (z.B Typ 4) für diese Einlagerung die Stimulation der Zelle durch Insulin benötigen. Leber-, Nieren-, Darmepithel- und b-Zellen des Pankreas exprimieren Typ 2 Transporter und benötigen daher kein Insulin, um Glucose aufzunehmen. Muskel- und Fettzellen exprimieren Typ 4 Transporter und benötigen Insulin, um Glucose aufnehmen zu können.
In Epithelzellen der Schilddrüsenfollikel
wird Tyrosin in das Glycoprotein Thyreoglobulin (660kD Protein)
eingebaut und Thyreoglobulin ins Lumen sekretiert. Im Lumen werden
Tyrosinreste am Thyreoglobulin durch das Enzym Thyroperoxidase am
Ring jodiert und dadurch in Mono-oder Dijodtyrosin
übergeführt (Fig. 19). Thyroperoxidase oxidiert I-,
überträgt die Elektronen auf H2O2 und spaltet damit H2O2 in
H2O. Der jodierte Ring eines Tyrosinrestes wird dann durch
Thyroperoxidase auf einen andern Tyrosinrest am Thyreoglobulin
übertragen (Schritt 3 in Fig. 19). Die Schilddrüse
konzentriert Jod etwa 100-fach über die Serumkonzentration. Der
Bedarf von Jod für den Menschen beträgt etwa 150 microgramm
pro Tag. Jodiertes Thyreoglobulin wird von Epithelzellen aus dem
Lumen aufgenommen und in Lysosomen mittels Proteasen degradiert.
Dabei werden T3 und T4 freigesetzt und von der Zelle entlassen.
Jodiertes Thyreoglobulin in der Schilddrüse stellt einen
"Hormonvorrat" für ca. 2 Monate dar. 
Fig. 19: Biosynthese von T3 und T4
Die Synthese geht von Cholesterin aus (Fig. 21, dicke Pfeile). Der geschwindigkeitsbestimmende Schritt ist die Abspaltung des C22-C27 Fragmentes durch das Enzym Desmolase. Dieses Enzym wird durch die Hormone FSH, LH und HCG aktiviert.

Fig. 21: Biosynthese der Sexual-Steroidhormone
Gn-RH (gonadotropin releasing hormone). Gn-RH ist ein 10 Aminosäuren langes Peptid. Es wird im Hypothalamus synthetisiert und erreicht über die Portalvene den Hypophysenvorderlappen. Dort stimuliert es Zellen (über Erhöhung der cAMP Konzentration) zur Synthese und Entlassung der Hormone FSH und LH.
FSH (Follikel-stimulierendes Hormon). FSH ist ein Glycoprotein, bestehend aus zwei Peptidketten (a=92 Aminosäuren, b= 118 Aminosäuren). Es wird in basophilen Zellen des Hypophysenvorderlappens synthetisiert. FSH reagiert mit membranständigen Rezeptoren und erhöht die Konzentration von cAMP in Zielzellen.
LH (Luteinisierendes Hormon). LH ist wie FSH ein Gycoprotein aus zwei Untereinheiten. Die a-Unteinheiten der beiden Hormone sind identisch. Die b-Unteinheit von LH ist 115 Aminosäuren lang. Für die Interaktion mit Zielzellen gilt dasselbe wie für FSH.
HCG (humanes Chorion-Gonadotropin). HCG besteht aus zwei Peptidketten (a, b). Es wird in Chorionzellen der Placenta synthetisiert, interagiert mit membranständigen Rezeptoren auf Zielzellen und führt zur Erhöhung der Konzentration von cAMP. HCG wird im Harn ausgeschieden und ermöglicht eine Frühdiagnose der Schwangerschaft in 8. Woche.