|
| Institut für Biochemische Pflanzenpathologie |
|
|
|
|
|
|
|
|
|
|
|
|
|
Wie Pflanzen sich schützen
Alle Organismen können in Stress geraten. Krankheiten, Schädlinge und veränderte Umweltbedingungen setzen Pflanzen und Tieren gleichermaßen zu. Die Abwehrmechanismen, mit denen sie diesen Faktoren begegnen, sind auf den ersten Blick sehr verschieden: Tiere besitzen spezialisierte Abwehrzellen und können sich durch Bildung von Antikörpern vor Krankheiten schützen, Pflanzen nicht.
Und doch funktioniert die generelle Grundabwehr auf molekularem Niveau bei Säugetieren, Insekten und Pflanzen ähnlich: Kennzeichen dieser angeborenen und damit im Genom verwurzelten Immunität sind konservierte Mechanismen der Pathogenerkennung und Signalweiterleitung. Alle Organismen verfolgen die selbe Strategie gegen Krankheitserreger: Sie produzieren Stickoxid (NO) und reaktiven Sauerstoff; sie induzieren programmierten Zelltod; sie exprimieren ähnliche Abwehrgene. Die auffälligen Parallelen zwischen tierischer und pflanzlicher Abwehrreaktion und die strukturelle und funktionelle Konservierung einiger Signaltransduktionswege deuten darauf hin, dass Pflanzen und Tiere Komponenten einer ursprünglichen, angeborenen Immunität gemeinsam haben.
Abwehrreaktionen als Überlebensstrategie
Die Fähigkeit, auf Umweltsignale und Angriffe von außen zu reagieren, ist für alle Tiere und Pflanzen überlebenswichtig: Ein Lebewesen, bei dem die Abwehrkräfte geschwächt sind, kann das Wachstum oder die Ausbreitung eines Pathogens nicht effektiv kontrollieren. Dadurch kommt es zu starker Schädigung, die in vielen Fällen zum Tod führt. Im Gegensatz dazu kann ein resistenter Organismus auf eine Reihe von Abwehrreaktionen zurückgreifen, die den Schädling daran hindern, sich auszubreiten.
Pflanzen haben ein ganzes Arsenal an schnellen und effizienten Abwehrreaktionen gegen eine große Bandbreite an Schädlingen zur Verfügung: Der Befall und die Ausbreitung von Bakterien, Pilzen, Viren und Nematoden können abgewehrt werden. Die natürlichen Schutzmechanismen von Pflanzen gegen Pathogene beruhen auf einer Reihe verschiedenartiger biochemischer und physiologischer Reaktionen, die in der Regel erst bei Pathogenbefall induziert werden, und dann Produkte bereitstellen, die direkt das Pathogen schädigen oder aber seine Verbreitung innerhalb der Pflanze stoppen.
Ein entscheidender Unterschied zwischen anfälligen und resistenten Pflanzen ist dabei die rechtzeitige Erkennung des eindringenden Pathogens und die schnelle und effektive Aktivierung von Abwehrmechanismen. Diese aktivierte Abwehrantwort zeigt sich häufig als sogenannte Hypersensitive Reaktion, die durch Induktion von programmiertem Zelltod an der Infektionsstelle charakterisiert ist, und die das Wachstum und die Ausbreitung des Schädlings verhindert. Die Hypersensitive Reaktion wird von der Aktivierung vieler Abwehrgene - darunter Defensine, Peroxidasen, Proteinaseinhibitoren - begleitet. Signalmoleküle, die von den sterbenden Zellen produziert werden, spielen wiederum eine Rolle bei der Induktion weiterer Abwehrgene: In benachbarten Zellen findet man verstärkte Ligninproduktion, Vernetzung von Zellwandproteinen und Kalloseauflagerungen. All diese Mechanismen dienen der physikalischen Verstärkung von Zellwänden und erschweren zum Beispiel Pilzen die Ausbreitung.
Zusätzlich zu der räumlich begrenzten Hypersensitiven Reaktion antworten viele Pflanzen auf eine Infektion mit der Aktivierung der Abwehr in uninfizierten Pflanzenteilen: Es kommt zur sogenannten systemisch erworbenen Resistenz (systemic aquired resistance, kurz SAR). Die Folge ist eine breite Resistenz gegen ein großes Spektrum von Pathogenen. Die Synthese antimikrobieller Produkte wie Phytoalexine und pathogeninduzierter (pathogenesis-related, PR) Proteine korreliert mit der Einleitung der Hypersensitiven Reaktion sowie mit systemisch erworbener Resistenz. Einige dieser Proteine sind Defensine oder hydrolytische Enzyme - beispielsweise Chitinasen oder ß-1,3-Glucanasen -, die Zellwände von Pilzen oder Bakterien abbauen können. Die Ausbildung einer systemisch erworbenen Resistenz nach Pathogenkontakt und erfolgter Hypersensitiven Reaktion ist vergleichbar mit der durch angeborene Immunität vermittelten adaptiven Immunität bei Tieren.
Die Aktivierung der Abwehrmechanismen erfolgt durch Signale, die entweder direkt vom eindringenden Pathogen stammen oder von ihm abgeleitet sind. Die Signaltransduktionskaskade umfasst G-Proteine, Ionenverschiebungen, reaktive Sauerstoffspezies (reactive oxygen species; ROS) und Phosphorylierungsketten mit Hilfe verschiedener (MAP) Kinasen. Zu den Signalmolekülen oder Hormonen, die an den Abwehrmechanismen beteiligt sind, gehören Stickoxid (NO), Octadecanoide (das pflanzliche Gegenstück zu Eicosanoiden) und Polypeptidhormone. Eine zentrale Rolle spielt hierbei die Salicylsäure (SA). Bereits Ende der 70er Jahre konnte gezeigt werden, daß exogen applizierte Salicylsäure in Tabak eine erhöhte Resistenz gegenüber dem Tabakmosaikvirus vermittelt. In der Folge bestätigten zahlreiche Publikationen die Rolle von Salicylsäure als endogenem Resistenzinduktor. Die Aktivierung von Transkriptionsfaktoren durch Signalmoleküle wie Salicylsäure führt am Ende zur Induktion von pflanzlichen Abwehrgenen und/oder zu programmiertem Zelltod (Apoptose).
Die Fähigkeit von Pflanzen, eine systemische Resistenz zu erwerben, macht sich der Mensch bei der Entwicklung neuer, ungiftiger Pflanzenschutzmittel zu Nutze: Diese Mittel sind nicht direkt gegen die Schädlinge gerichtet, sondern stärken die natürlichen Abwehrkräfte von Pflanzen. Einige dieser sogenannten "Pflanzenaktivatoren", die vermutlich funktionelle Analoga des natürlichen Pflanzenhormones Salicylsäure darstellen, sind bereits im Handel und werden bei verschiedenen Kulturpflanzen wie Weizen, Reis und Tabak erfolgreich eingesetzt. Die Praxis zeigt, dass das natürliche Abwehrsystem von Pflanzen genutzt werden kann, um die Resistenz gegenüber biotischen und abiotischen Stressfaktoren zu verbessern.
Aktivierung der Abwehr
Die Resistenz einer Pflanze kann nicht isoliert betrachtet werden. Sie ist nach dem "Gene-for-Gene-Prinzip" abhängig von der Spezifität eines Pflanzenresistenz-Gens (R-Gens) zu einem bestimmten Avirulez-Gen (avr-Gen) des Erregers. Ähnlich wie bei der tierischen Immunantwort kontrollieren diese Gene die Interaktion zwischen Rezeptor und Ligand, die die komplexe Abwehrantwort der Wirtspflanze auslöst. Es gibt hunderte von Resistenz-Genen für die spezifische Erkennung bestimmter Pilze, Bakterien, Viren und Nematoden. Wenn entweder dem Wirt oder dem Pathogen das entsprechenden Resistenz- beziehungsweise Avirulenzgen fehlt, führt dies zur Infektion durch das Pathogen und zu Krankheit.
|
|
|
 |
Abb.1
Induktion systemischer Resistenz in Tabak.
Die Pflanze rechts im Bild wurde mit Tabak-Mosaic-Virus (TMV) behandelt, und zeigt eine typische hypersensitive Reaktion (HR): Die befallenen Zellen leiten den progammierten Zelltod ein. Die linke Pflanze wurde einige Tage zuvor mit dem Virus infiziert (unten). Eine neuerliche Infektion (oben) verdeutlicht die erheblich verbesserte Abwehrreaktion (systemic acquired resistance, SAR).
|
|
|
|
Resistenzproteine, die Produkte der Resistenzgene, sind entweder Transmembran-Rezeptoren oder intrazelluläre Rezeptoren, die nach Bindung des vom Pathogen stammenden Liganden Signaltransduktionskaskaden auslösen. Wichtige Strukturmerkmale der Resistenzproteine sind Nukleotid-Bindestellen (NBS), Leucin-Zipper-Motive (LZ) und Leucin-reiche DNA-Abschnitte (LRR). Alle diese Domänen existieren auch in Proteinen des angeborenen Immunsystems von Wirbeltieren (Beispiele sind hier: der IL-1 Rezeptor (IL-1R) bei Säugetieren, die Toll-Proteine (TIR [Toll/IL-1R]) bei der Fruchtfliege Drosophila und anderen Insekten; (vgl. Abb. 2). Fazit: Es gibt generelle Abwehrstrategien, die im Laufe der Evolution konserviert wurden.
Eine wichtige Klasse der Resistenzgene sind die cytoplasmatischen Proteine, die eine Region mit Toll-Proteinen enthalten. Ein Beispiel hierfür ist das gut charakterisierte N Protein aus Nicotiana tabacum. Es gehört zur TIR-NBS-LRR Klasse der pflanzlichen Resistenzgene und bietet Schutz vor dem Tabak-Mosaik-Virus (TMV); (siehe auch Abb. 1). Das N Gen kodiert für zwei Transkripte, die Hüllwandproteine dieses Virus erkennen und die nur gemeinsam eine völlige Resistenz gegen das Tabak-Mosaik-Virus vermitteln.
Auffällig ist, dass viele Resistenzgenprodukte von Pflanzen ähnliche Motive wie die Rezeptoren des angeborenen Immunsystems von Säugern aufweisen. Dies hat zahlreiche Forscher veranlasst, die molekularen Mechanismen dieser - ganz offensichtlich im Laufe der Evolution konservierten - Abwehrsysteme zu untersuchen. Ergebnis: Es gibt große Ähnlichkeit unter den für die Pathogenerkennung notwendigen Rezeptoren (R-Proteine), sowie bei der Signalweiterleitung und Aktivierung von Abwehrantworten in Pflanzen, Insekten und Wirbeltieren. Parallelen zeigen sich bei signalweiterleitenden Proteinen wie G-Proteine, Kinasen oder Transkriptionsfaktoren, aber auch beim Einsatz von Signalmolekülen wie reaktive Sauerstoffspezies oder Stickoxid.
|
|
|
|
|
Abb. 2
Aktivierung der angeborenen Immunität in Säugern, Insekten und Pflanzen. Die Abwehrantworten von Säugern, Insekten und Pflanzen werden offensichtlich durch ähnliche Mechanismen gesteuert. Dargestellt sind hier die wichtigsten Komponenten, mit denen Wirtszellen Pathogene erkennen, und dieses Signal weiterleiten bzw. in Aktivierung von Abwehrgenen umsetzen.
Bei Säugern spielen Rezeptoren der Toll-Interleukin-Klasse (TLR, z.B. IL-1R) eine entscheidende Rolle bei Immunität und Entzündungsantworten. Nach Erkennung eines Pathogens (oder eines Signals, das vom Pathogen ausgeht) bindet das Adapterprotein MyD88 an den Rezeptor und interagiert durch eine konservierte "death domain" mit IRAK (einer Kinase). IRAK wiederum aktiviert den IkB/NF-kB Komplex, ein Transkriptionsfaktor, der zur Aktivierung von Abwehrgenen beiträgt.
Die Produktion von antimikrobiellen Peptiden in der Fruchtfliege Drosophila basiert auf einem Signalweg, der dem oben beschriebenen ähnelt: Nach Bindung eines Liganden (Pathogensignal) iniziiert der Toll-Rezeptor eine Signalkaskade, an der die Proteine Tube und Pelle beteiligt sind. Diese Proteine sind homolog zu den Säugerproteinen MyD88 und IRAK. Auch bei Insekten erfolgt die Aktivierung von Abwehrgenen durch einen Transkriptionsfaktor der NF-kB-Proteinfamilie (Dorsal/DIF).
Wichtige Komponenten, die die angeborene Immunantwort von Pflanzen einleiten, sind Rezeptoren wie das N-Protein oder auch Xa21 oder CF-9, die eindringende Pflanzenpathogene erkennen können. Diese Rezeptoren beinhalten die strukturellen und funktionellen Elemente der TLR-Rezeptoren von Säugern oder des Toll-Rezeptors von Insekten. Andere interessante Homologien finden sich bei den den Kinasen (PK), Transkriptionsfaktoren wie Myb oder bei regulativen Proteinen wie NPR1 (pflanzliches Homolog zu IkB). Die dargestellten pflanzlichen Komponenten stellen im übrigen lediglich eine Auswahl dar. Pflanzen scheinen z.B. eine wesentlich höhere Anzahl an Rezeptoren zur Pathogenerkennung zu besitzen als Tiere (modifiziert nach Cohn at el., 2001).
|
|
|
Reaktiver Sauerstoff: entscheidend für die pflanzliche Abwehr
Eine massive Akkumulation von reaktiven Sauerstoffspezies nach Pathogeninfektion wurde erstmals 1983 in Kartoffelknollen entdeckt. In den folgenden Jahren wurde diese Abwehrreaktion in einer Vielzahl von Pflanze-Pathogen-Interaktionen aber auch nach Ozon- oder Starklichtbehandlung beobachtet. Der inzwischen eingebürgerte Begriff "oxidativer Burst" wurde dabei in Analogie zum "respiratory Burst" bei der tierischen Pathogenabwehr eingeführt. Die primär in einem "oxidativen Burst" erzeugte Spezies ist zumeist das Superoxidanion-Radikal (O2-), das spontan oder durch Superoxiddismutase katalysiert und zur Bildung von Wasserstoffperoxid führt. Der "oxidative Burst" besitzt eine zentrale Stellung bei der pflanzlichen Pathogenabwehr: Er bewirkt direkte antimikrobielle Reaktion sowie katalytische Funktionen bei der Vernetzung von Zellwandproteinen und phenolischen Verbindungen. In den letzten Jahren wurde zudem wichtige Funktionen von reaktive Sauerstoffspezies als Signale bei der Auslösung einer ganzen Batterie von lokalen und systemischen Resistenzantworten erarbeitet.
Woher stammt nun diese massive Produktion von reaktiven Sauerstoffspezies in infizierten Pflanzen? Eine Vielzahl von Enzymen wie Aminoxidasen, Oxalatoxidase, Peroxidasen und NADPH-Oxidase können Superoxid oder Wasserstoffperoxid produzieren. Mit Hilfe von Inhibitorstudien und neuerdings auch Mutantenanalysen wurde die Bedeutung von NADPH Oxidasen, homolog zu bekannten tierischen Enzymen, bei der Produktion von Reaktiven Oxygen Spezies und der damit verbundenen Signaltransduktion unter abiotischem und biotischem Streß erkannt. Die Produktion von reaktiven Sauerstoffspezies erfolgt in Phagozyten von Säugern durch einen in der Zellmembran lokalisierten NADPH-Oxidase-Komplex. Dieser besteht aus der membranlokalisierten katalytischen Untereinheit gp91phox ( einem Flavocytochrom b558) sowie drei cytosolischen Untereinheiten. In der Zelle binden sich nach Wahrnehmung entsprechender Stimuli die cytosolischen Proteine an die katalytische Untereinheit, dabei bildet sich der aktive NADPH-Oxidase-Komplex. Pflanzliche Homologe von gp91phox wurden in den letzten Jahren in Reis, Tomate, Kartoffel und Arabidopsis thaliana identifiziert. Am GSF-Institut für Biochemische Pflanzenpathologie konnten zudem zwei Homologe in Tabak identifiziert werden, die wahrscheinlich an der unterschiedlichen Empfindlichkeit von Pflanzen gegenüber dem Luftschadstoff Ozon beteiligt sind. Im Arabidopsis-Genom wurden bislang zehn homologe Sequenzen zu gp91phox, gefunden, die jedoch nicht vergleichbar sind mit den cytosolischen Untereinheiten aus Säugern. Seit kurzem gibt es zudem Hinweise, dass diese katalytische Untereinheit in Pflanzen - wie auch in nichtphagozytischen Zellen von Tieren und Mensch - für sich alleine und ohne weitere cytosolische Komponenten funktionell sein kann. Damit ist eine wichtige Voraussetzung für eine gentechnische Modulation des "oxidativen Bursts" in Pflanzen erfüllt.
Stickoxid: der Schlüssel zur Pflanzenimmunität
Stickoxid (NO) spielt im tierischen und pflanzlichen Stoffwechsel eine Schlüsselrolle. Wegen der Vielzahl physiologischen Funktionen, an denen Sickoxid beteiligt ist, steht dieser Stoff für die Forschung im Zentrum des Interesses. Er ist ein inter- und intrazellulärer Mediator von zahlreichen Zellfunktionen einschließlich der angeborenen Immunität. So sind die Interaktionen von Stickoxid mit Redoxzentren von Proteinen wichtige Schlüsselreaktionen in Signaltransduktionswegen bei der Kontrolle von glatter Muskulatur, Neurotransmission, Zellproliferation, Apoptose und bei der Antwort auf Infektionen. Stickoxid kann frei diffundieren. Seine biologischen Eigenschaften sind durch seine chemische Reaktivität gegenüber Sauerstoff, reaktiven Sauerstoffspezies und Metallen festgelegt. Bei Säugetieren spielt die Freisetzung über die induzierbare Stickoxid -Synthase (iNOS) eine wichtige Rolle bei Entzündungen, Abwehrantwort und Gewebereparatur. So korreliert die Expression von induzierbarer Stickoxid -Synthase oft mit erhöhter antimikrobieller Aktivität, während Inhibitoren häufig die Anfälligkeit gegenüber Pathogenen erhöhen. Cytokinine und Endotoxine induzieren ebenfalls Stickoxid-Synthase. Zusätzlich ist das Reaktionsprodukt von Stickoxid mit Sauerstoff, das Peroxynitrit (ONOO-), toxisch für Mikroorganismen - Stickoxid alleine hat diese Wirkung nicht.
In den letzten Jahren wurden vielerlei Hinweise dafür gefunden, dass Stickoxid ein neuartiger Effektor in der Pflanzenabwehr ist. Erste Hinweise auf eine säugetierähnliche Stickoxid-Synthase (NOS) in Pflanzen wurden 1996 publiziert. In jüngerer Zeit wurde am GSF-Institut für Biochemische Pflanzenpathologie und an anderen Forschungseinrichtungen gezeigt, dass Stickoxid und möglicherweise auch Stickoxid-Synthase eine wichtige Rolle in der Pflanzenabwehr gegen mikrobielle Schädlinge spielen. Stickoxid kann zahlreiche Abwehrgene induzieren und spielt auch eine Rolle bei der direkten Bekämpfung von Pathogenen. Die Signalkette ist abhängig von der direkten Wirkung von Stickoxid und von Botenstoffen wie zyklischem GMP (cGMP) und zyklischer ADP Ribose (cADPR). Verschiedene neuere Publikationen bestätigten die Beteiligung von Stickoxid und Peroxynitrit an der pflanzlichen Apoptose, Genregulation und Abwehrantwort gegen Pathogene. Außer den Parallelen zu tierischen Systemen wurden auch einige interessante Unterschiede wie die Beteiligung von cGMP an der pflanzlichen Apoptose festgestellt (vgl. Abb. 3).
|
|
|
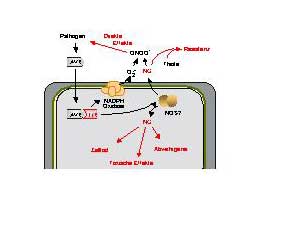
Abb. 3:
Die Funktion von Stickoxid bei der pflanzlichen Abwehrreaktionen
Erkennt ein Resistenzgen ein Pathogen oder einen Avirulenzfaktor ,so aktiviert die Pflanze Mechanismen zur Produktion von reaktivem Sauerstoff und Stickoxid. Zweiteres spielt eine Rolle bei der Induktion des Zelltods und bei der Aktivierung von Abwehrgenen. Stickoxid kann dabei sowohl auf den Wirt als auch auf das Pathogen toxisch wirken. Möglicherweise wirkt es auch, gebunden an niedermolekulare Thiole, als Langstreckensignal.
|
 |
|
|
In jüngerer Zeit wurde eine neue Klasse von Fluoreszenzfarbstoffen mit hoher Spezifität für Stickoxide entwickelt, die eine Echtzeitdarstellung der Stickoxid-Produktion erlaubt. Diaminofluoresceine (DAFs) reagieren nicht mit reaktiven Sauerstoffspezies und senken die Detektionsgrenze für Stickoxid auf 5 nanomolar. Am GSF-Institut wurde der Floureszenzfarbstoff DAF-2 DA für die Detektion von Echtzeitdarstellung von Stickstoff in lebenden Zellen verwendet. Ergebnis: Werden Tabak-Epidermiszellen mit Cryptogein, einem Elicitor des Pilzes Phytophtora cryptogena, behandelt, so antworten sie mit einer starken Erhöhung der intrazellulären Stickoxid-Konzentration. Stickoxid-induzierte Fluoreszenz wurde in verschiedenen Zellkompartimenten gefunden. Die Stickoxid Freisetzung trat innerhalb von Minuten auf, ähnlich wie beim oxidativen Burst während der Hypersensitiven Reaktion (Abb. 4 und 5). |
|
|
|
|
|
|
|
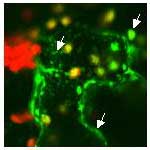
Abb.4:
Stickoxide im Visier (I)
Die Pathogen induzierte Stickoxid-Produktion in Tabak lässt sich mit Hilfe von Floureszenz sichtbar machen. Die intrazelluläre DAF-2DA-Fluoreszenz ist dabei ein Maß für die Stickoxid-Bildung in Tabak-Epidermiszellen nach Stimulierung mit einem pilzlichen Signalmolekül (Cryptogein aus Phytophthora). Die Epidermiszellen wurden mit DAF-2 DA geladen, dann mit Cryptogein behandelt und mittels Konfokaler Laser Scanning Mikroskopie analysiert.
(a) zeigt eine Durchlicht-Aufnahme,
(b) den Stickoxid-Burst hervorgerufen durch den Elicitor und dargestellt als DAF-Fluoreszenz,
(c) stellt eine Komposition beider Aufnahmen dar.
|
Abb. 5:
Stickoxid macht Abwehrreaktionen sichtbar (II).
Die Floureszenzaufnahmen zeigen die Konzentration von Stickoxid entlang der Zellmembran, in Chloroplasten und in Peroxisomen. Dargestellt ist die intrazelluläre DAF-2DA Fluoreszenz in Tabak-Epidermiszellen nach Stimulierung mit Cryptogein.
|
|
|
Blick in die Zukunft
Verschiedene Schlüsselkomponenten der angeborenen Immunität von Säugern spielen auch im Abwehrsystem von Pflanzen eine wichtige Rolle. So helfen Elemente des tierischen Abwehrsystems - beispielsweise Defensine und Stickoxid - auch Pflanzen bei der Verteidigung gegen Schädlinge. Die Forschungsarbeiten auf diesem Gebiet werden einen wichtigen Beitrag zu unserem Verständnis der Grundprinzipien der angeborenen Immunabwehr von Tieren und Pflanzen leisten. Gleichzeitig liefern sie die Grundlagen für die gentechnische Aktivierung der natürlichen Abwehrsysteme von Pflanzen.
Derzeit werden große Anstrengungen unternommen, die Anwendung von belastenden Pflanzenschutzmitteln in der Landwirtschaft zu reduzieren. Die natürliche Resistenz vieler Pflanzen gegen Pathogene lässt sich einsetzen, um die Produktion von Nahrungsmitteln umweltverträglicher zu machen. Ein erster erfolgreicher Schritt, die pflanzliche Gesundheit und Abwehrbereitschaft gegen Pathogene zu stärken, ist die Induktion systemischer Resistenz durch neuartige Pflanzenschutzmittel. Synthetische Pflanzenaktivatoren oder die so genannten "Biocontrol agents" bestehend aus Bakterien und Pilzen, wirken nicht auf die Pathogene, sondern regen die pflanzliche Resistenz an. Die Erforschung des pflanzlichen Immunsystems wird biotechnologisch von großem Nutzen sein. In einer späteren Phase könnte anstelle chemischer Immunstimulantien oder der Expression von Fremdgenen eine "sanfte" Gentechnologie treten. Das Ziel ist dabei, durch ein Feintuning der an der Immunantwort beteiligten pflanzeneigenen Gene die Abwehrbereitschaft unserer Nutzpflanzen zu erhöhen.
Uta von Rad, Christian Langebartels, Jörg Durner
Literatur
Durner, J., Gow, A. J., Stamler, J. S., and Glazebrook, J. (1999). Ancient origins of nitric oxide signaling in biological systems, Proc Natl Acad Sci USA 96, 14206-14207.
Sandermann, H. (2000). Active oxygen species as mediators of plant immunity: Three case studies., Biol Chem 381, 649-653.
Foissner, I., Wendehenne, D., Langebartels, C., and Durner, J. (2000). In vivo imaging of an elicitor-induced nitric oxide burst in tobacco, Plant J 23, 817-824.
Wendehenne, D., Pugin, A., Klessig, D. F., and Durner, J. (2001). Nitric oxide: comparative synthesis and signaling in animal and plant cells, Trends Plant Sci 6, 177-83.

HOME
|
|
|
|
|
|
|
|
|
|
|