|
|
 |
| Gyromitra esculenta: Der Gyromitringehalt getrockneter Lorcheln reicht von »nicht nachweisbar« bis zu 50% des Ausgangsgehaltes der frischen Lorcheln. |
Apotheker Jens Bielenberg
Natürliche toxische Substanzen
Vitaminantagonisten in Nahrungsmitteln
Antivitamine. Wie keiner seiner Vorfahren ist der Mensch der Gegenwart mit einem so komplexen Gemisch chemischer Substanzen in Form von Arzneimitteln, Hilfs- und Zusatzstoffen in Lebensmitteln sowie Schadstoffen aus der Umwelt konfrontiert. Veränderte soziologische Rahmenbedingungen schaffen den Nährboden für exzessiven Genussmittelkonsum. Alkohol, Nikotin und Drogen belasten auf vielfältige Weise den Vitaminstoffwechsel. Doch auch natürliche Nahrungsmittel greifen in diesen Stoffwechsel ein.
Nicht nur Xenobiotika verändern unseren Vitaminstoffwechsel, auch natürliche Nahrungsmittel können in vielfacher Weise in unseren Stoffwechsel eingreifen. Besonders einseitige Ernährung verursacht Krankheitssymptome in Verbindung mit Vitaminantagonisten in Nahrungsmitteln.
Beriberi, eine in vielen Provinzen Thailands weitverbreitete Hypovitaminose, wird nicht nur durch einen Mangel an Vitamin B1 verursacht, sondern auch durch besondere Ernährungsgewohnheiten wie das Kauen von Tabakblättern und Betelnüssen. Auch der Verzehr roher fermentierter Fische kann zu Thiamindefiziten führen. Verschiedene Speisepilze können durch Inhaltstoffe, die sich gegenüber Vitamin B6 antagonistisch verhalten, toxisch wirken. Inzwischen ist eine Vielzahl von natürlichen Vitaminantagonisten – Antivitamine – bekannt, die auf vielfältige Weise in den Vitaminstoffwechsel eingreifen. Antivitamine haben folgende Eigenschaften:
 Ihre Applikation führt zu ähnlichen Mangelsymptomen wie das Fehlen des entsprechenden Vitamins. Ihre Applikation führt zu ähnlichen Mangelsymptomen wie das Fehlen des entsprechenden Vitamins.
 Applikation des entsprechenden Vitamins macht die Mangelsymptome rückgängig. Applikation des entsprechenden Vitamins macht die Mangelsymptome rückgängig.
 Die Antivitamine ähneln häufig strukturell dem entsprechenden Vitamin. Die Antivitamine ähneln häufig strukturell dem entsprechenden Vitamin.
Antivitamine sind deshalb von Interesse, weil »Modell-Hypovitaminosen« verursacht werden können, die wichtige Erkenntnisse über die Symptomatik von Vitamindefiziten liefern. Daraus ergeben sich Ansatzpunkte, Krankheitssymptome als Hypovitaminosen zu identifizieren.
Viele Antibiotika entpuppen sich als Strukturanaloga von Vitaminen, die die Biosynthese von Vitaminen in Bakterien blockieren. Der folgende Artikel soll einen kurze Übersicht über die wichtigsten natürlichen Vitaminantagonisten geben.
 |
| Abb. 1: Stoffwechsel des Pyridoxalphosphats, das als Cofaktor zahlreicher Enzyme wirkt: Pyridoxalkinase, Pyridoxaminphosphatkinase, alkalische Phosphatase und Aldehydoxidase sind Katalysatoren des Vitamin-B6-Stoffwechsels. |
Vitamin B6-Antagonisten
 aus natürlich vorkommenden Hydrazinen aus natürlich vorkommenden Hydrazinen
Hydrazine, substituierte Hydrazine, Hydrazide und Hydrazone haben in jüngerer Zeit das Interesse von Pharmakologen, Toxikologen, Biochemikern, Raumfahrtbiologen und Ökologen gefunden. Grund ist die hohe chemische Reaktivität und die vielfältigen biochemischen Aktivitäten sowie die therapeutischen Anwendungsmöglichkeiten. Hydrazine finden Verwendung in der Raumfahrt als Raketentreibstoffe und werden in der Medizin als Antidepressiva, Antituberkulostatika, Antihypertensiva und Zytostatika angewendet. Das Spektrum toxischer Effekte durch Hydralazin ist groß. Es wird über Hepatitiden, Lupus erythematodes, Thrombozytopenien, Polyneuritis sowie genotoxische Reaktionen nach dem Antihypertonikum Hydralazin berichtet. Toth und Erikson, Institute for Research in Cancer, University of Nebraska, Medical Center (1), bewiesen durch subkutane Injektion von vier verschiedenen Hydrazinen (Methylhydrazin, Glutamylhydroxymethylpenylhydrazin, Ethylhydrazin, n-Butylhydrazin) an Schweizer Mäusen, dass durch vorherige oder spätere Injektion von Vitamin B6 Krämpfe sowie weitere toxische und letale Effekte verhindert werden konnten. Unter dem Aspekt der Bildung von Pyridoxalhydrazonen, die die Pyridoxalphosphatkinase hemmen und damit die Phosphorylierung, d.h. die Aktivierung zur Coenzymform, unterbinden, wird die hydraininduzierte Krampfpathogenese verständlich, da Pyridoxalphosphat ein Coenzym der Glutamatdecarboxylase ist, die den exzitatorischen Neurotransmitter Glutamat in die inhibitorisch wirkende Gamma-Aminobuttersäure umwandelt.
Linatin
Die Beobachtung, dass Hühner unter Leinsamendiät Wachstumsdefizite aufweisen, die durch gleichzeitige Pyridoxinsubstitution aufgehoben werden konnte, führte zur Entdeckung des Vitamin-B6-Antagonisten Linatin im Leinsamen. Hydrolyse des Linatin liefert 1-Amino-D-Prolin, ein asymmetrisch substituiertes Hydrazinindervat, das verantwortlich ist für die Neurotoxizität von Leinsamen (Linum usitatissimum). Klostermann wies Linatin in Leinsamen in einer Konzentration von 100 ppm nach. Die durch hohe Linatin-Dosen verursachten Krämpfe waren nicht unterscheidbar von denen, die durch Vitamin-B6-Defizite oder durch Hydrazine ausgelöst wurden.
 |
|
Abb. 2, 2a und 2b: Gyromitrin aus Gyromitra esculenta und seine Hydrolyseprodukte
|
Gyromitrin und Phenylhydrazin
Gyromitra esculenta ist einer der beliebtesten wilden Speisepilze. Gelegentlich wird über leichte Unpässlichkeiten nach Genuss des Pilzes berichtet. List und Luft fanden in Extrakten von Gyromitra esculenta, auch Frühjahrslorchel oder Speiselorchel genannt, Gyromitrin (Abb. 2), N-Methyl-N-formyl-hydrazin (Abb. 2a) und Methylhydrazin (Abb. 2b).
Der Giftstoff ist das Monomethylhydrazin (MMH), das an verschiedene niedermolekulare Aldehyde gebunden vorliegt. Das Intoxikationsrisiko ist von der Art der Zubereitung abhängig. Durch Kochen in einem geschlossenen Topf können leicht Vergiftungen durch Methylhydrazin auftreten, die durch Vitamin B6 aufgehoben werden. Gefahr durch Verzehr von Gyromitra esculenta besteht besonders für ältere Menschen, Kinder und Patienten mit Leberfunktionsstörungen.
Cave: Weder das Kochen noch das Verwerfen des Kochwassers schützt absolut vor einer Vergiftung.
Aufgrund der Flüchtigkeit des Methylhydrazins unterliegt der Koch einem nicht zu unterschätzenden Intoxikationsrisiko durch Inhalation.
Da das Gift flüchtig ist, geht es beim Trocknen und dem anschließenden mehrwöchigen, offenen Lagern der Pilze verloren. Ein Teil der Hydrazine liegt jedoch in gebundener Form vor und ist nicht flüchtig. Der Gyromitringehalt getrockneter Lorcheln reicht von »nicht nachweisbar« bis zu 50% des Ausgangsgehaltes der frischen Lorcheln. Es besteht der Verdacht, dass jahrelanger Verzehr auch von vorschriftsmäßig abgekochten Frühjahrsmorcheln zur Bildung von Antikörpern führt, die eine komplexe allergische Reaktion auslösen können. Die Verwendung als Marktpilz ist in Deutschland nicht mehr zugelassen.
Methylhydrazine sind Alkylantien und kanzerogen. Die Entgiftung erfolgt durch Acetylierung. Es ist durchaus denkbar, dass Langsamacetylierer infolge genetischer Prädisposition ein höheres Krebsrisiko aufweisen. Der Vergiftungsverlauf durch Gyromitra esculenta ist gekennzeichnet durch anhaltende Schwäche und Übelkeit. Nach einer Latenzzeit von 1 bis 2 Tagen entwickelt sich ein Ikterus und Leberversagen. Analog synthetischen Hydrazinen verursacht Gyromitrin neurotoxische Reaktionen wie Unruhe, Kopfschmerzen, Delirien und Krämpfe. Dies ist auf die Wirkung der oft wochenlang aus den acetylierten Hydrazinen entstehenden Acyl-Radikale, die stark hepatotoxisch wirken, zurückzuführen. Die Sterblichkeit wird mit 10% angegeben (2).
 |
|
Abb. 3 und 4: Agaritin
|
Agaritin
Agaricus bisporis ist ein Speisepilz, der mit 0,3% Agaritin (Glutamyl-4-
Hydroxy-methyl-phenyl-hydrazin) ebenfalls ein Hydrazinderivat enthält. Agaritin war ebenfalls Gegenstand der bereits erwähnten Studie von Toth und Erikson, die auch für dieses Hydrazinderivat toxische, konvulsive und letale Effekte beschrieben, die durch präventive und therapeutische Gaben von Pyridoxinhydrochlorid antagonisiert werden könnten. Enzyme, die eine Glutamyl-Transferase-Aktivität haben, sind in der Natur weit verbreitet. Agaricus bisporis besitzt ebenfalls ein derartiges Enzym, so dass mit der Freisetzung von 4-Hydroxymethylphenylhydrazin zu rechnen ist (Abb. 3 und 4).
 aus natürlich vorkommenden Hydroxylaminen aus natürlich vorkommenden Hydroxylaminen
Canavanin und Canalin
60% aller bisher getesteten Leguminosen, so auch Canavalia-Arten, enthalten Canavanin, ein Hydroxylaminderivat (3). Canavanin selbst weist bei Mäusen eine geringe Toxizität auf. Viele Leguminosen besitzen jedoch mit der Canavanase ein Enzym, das Canavanin in Harnstoff und L-Canalin aufspaltet, dazu sind auch Leberhomogenisate und Saubohnen durch Hydrolyse oder Transaminierung mit Ornithin in der Lage. Canalin kann als substituiertes Hydroxylamin Oxime mit Pyridoxal oder Pyridoxalphosphat bilden. Oxime können die Pyridoxalphosphatkinase und damit die Aktivierung von Vitamin B6 blockieren. Canavanin ist ein Strukturanalogon von L-Arginin und als dieses fähig, Enzyme aus Makrophagen zu blockieren, die aus Arginin NO, einen hormonalen Botenstoff, bilden. (Abb. 4a); dieser reguliert unter anderem über den endothelialen relaxierenden Faktor (EDRF) den Gefäßwiderstand und den peripheren Widerstand des Herz-Kreislauf-Systems (4). Das Leguminosenkraut Medico sativa (Luzerne, Alfalfa) enthält in den Samen 5 bis 15 mg/g L-Canavanin (5) (Abb. 5, 6)
 |
| Abb. 4a: Hypothetische molekulare Mechanismen der Bildung von NO oder NO-haltigen Substanzen aus L-Arginin. Verschiedene hormonale und nicht-hormonale Wirkstoffe stimulieren über spezifische plasmamembranständige Rezeptoren und wahrscheinlich Guaninnukleotid-bindende Proteine (G) ein plasmamembranständiges Effektorsystem (Eff) und bewirken so die Aktivierung eines vermutlich zytosolischen Enzym(system)s, welches aus einem oder beiden der terminalen Stickstoffatome von L-Arginin NO oder eine labile NO-haltige Verbindung (R-NO) bildet. Die Umsetzung von L-Arginin benötigt wahrscheinlich NADPH als Cofaktor und wird durch Strukturanaloga von L-Arginin wie L-Canavanin und NG-Monomethyl-L-Arginin (L-NMMA) inhibiert. |
 |
|
Abb. 5 und 6: Canavanin und L-Canalin
|
Alfalfa kann beim Menschen einen systemischen Lupus erythematodes (LE) mit Hautreaktionen und gastrointestinalen Störungen auslösen. Auch Affen entwickelten, nachdem sie über 2 Monate mit einer Diät gefüttert wurden, die 45% rohe Alfalfa-Samen und 40% Alfalfa-Sprosse enthielt, ein LE-ähnliches Syndrom. Da nicht alle Tiere krank wurden, wird eine genetische Prädispostion diskutiert. Weitere serologische und hämatologische Abnormitäten nach Alfalfa-Diät waren: positiver Coombs-Test (Nachweis kompletter Antikörper), hämolytische Anämien, erhöhte Konzentrationen doppelsträngiger DNA. Immunkomplex-induzierte Glomerulonephrititiden, Splenomegalie, Ablagerung von Immunglobulinen und Komplementen an dermal/epidermalen Verbindungsstücken sowie Lethargie, Alopecia, Depression und Anthralgie wurden nachgewiesen (6).
 |
|
Abb. 7: Cycloserin
|
Cycloserin
Wie Canalin ist auch Cycloserin ein Hydroxylaminderivat. Verschiedene Actinomyces-Arten produzieren dieses Antibiotikum, das in der Therapie der Tuberkulose angewendet wird. Cycloserin ist ein Antimetabolit, der aufgrund der Strukturähnlichkeit mit D-Alanin als kompetitiver Antagonist Isomerasen und Dipeptidasen blockiert, die an der Mureinbiosynthese beteiligt sind (Abb. 7).
Auch Cycloserin, das das nächstniedrigere Homologe des Canalins ist, kann mit Pyridoxalphosphat Oxime bilden und wirkt als Inhibitor pyridoxalphosphatabhängiger Reaktionen. Hydrazone und Oxime vermögen um den Faktor 100 bis 1.000 fester an die Pyridoxalphosphatkinase zu binden als Pyridoxal. Als Nebenwirkungen stehen neurotoxische Effekte im Vordergrund: Kopfschmerz, Schwindel, Somnolenz, Konzentrationsstörungen, Angst ,Verwirrtheit, Halluzinationen, Depressionen mit Suizidgefahr sowie Paresen, Parästhesien, Tremor und motorische Störungen.
Mimosin
In den Blättern der Leguminosen Mimosa und Leucaena kommt Mimosin vor, ein 3-Hydroxy-Pyridinalanin, das bei Tieren zu Intoxikationen führt. Mimosin bildet mit Pyridoxalphosphat einen Komplex und blockiert einige Vitamin-B6-abhängige Enzyme.
Beta-Cyanoalanin
Neurotoxische Wirkungen, verursacht durch Vicia-Arten, lassen sich bei der Ratte teilweise durch Pyridoxal antagonisieren, so dass ein Antagonismus gegenüber Vitamin B6 naheliegt.
Penicillamin
Penicillamin ist ein Abbauprodukt des Penicillins und findet aufgrund seiner Chelatbindungseigenschaften Anwendung bei Vergiftungen mit Schwermetallen sowie in der Rheumabehandlung. Über einen Antipyridoxin-Effekt von Penicillamin ist bereits in den 60er Jahren berichtet worden. Penicillamin komplexiert Kupfer, was die Wirkung bei Kollagenosen erklären konnte. Vitamin B6 und Kupfer sind Cofaktoren der Lysinoxydase, dem geschwindigkeitsbestimmenden Schritt der Kollagenbiosynthese.
Nach Penicillamin ist das Auftreten eines Lupus erythematodes beobachtet worden, ferner Purpurea (nach Schönlein-Henoch), hämolytische Anämien, nephrotisches Syndrom, Thrombozytopenien und in seltenen Fällen Myastenien. Interessanterweise reagieren 40 bis 60% aller Patienten mit Penicillinallergie auch auf Penicillamin allergisch.
Alkohol
Bei Alkohol ist die Dosis das entscheidende Kriterium dafür, ob es als Nahrungsmittel, als Genussmittel, als Gift oder als Rauschmittel anzusehen ist. Schon ab 30 g Alkohol entwickeln sich vitaminantagonistische Effekte, die auch mit beginnenden Rausch- und Intoxikationserscheinungen korrelieren. Bekannt sind Interaktionen von Alkohol mit Biotin, Panthothensäure, Folsäure, Thiamin, Ascorbinsäure, Riboflavin und Pyridoxin. Vitamin B6 wird durch passive Diffusion im oberen Jejunum resorbiert. Der Ablauf der Vitamin-B6-Resorption wird sehr stark durch Phosphorylierungs- und Dephosphorylierungsvorgänge geprägt. Alkohol-induzierte Zinkdefizite inaktivieren die alkalische Phosphatase im Jejunum und hemmen dadurch die Pyridoxylphosphatresorption. Ferner ist die Speicherfähigkeit gehemmt. Auch wird die Phosphokinase durch Acetaldehyd blockiert und somit Pyridoxal nicht zur aktiven Coenzymform phosphoryliert.
Vitamin-B1-Antagonisten
Zahlreiche Natursubstrate enthalten Bestandteile, die Thiamin zersetzen. Hierzu gehören Enzyme wie auch niedermolekulare Stoffe. Die thiaminzerstörende Wirkung von Thiaminasen ist Gegenstand gründlicher Studien gewesen.
Thiaminasen
Die zwei verschiedenen Typen von Thiaminasen katalysieren die Aufspaltung des Thiaminmoleküls an der Methylenbrücke in Thiazol- und Pyrimidin-Derivate. Die Mechanismen der beiden Thiaminasen unterscheiden sich jedoch.
Thiaminase 1 katalysiert die Spaltung des Thiamins durch eine Austauschreaktion mit einer Stickstoffbase oder einer SH-Verbindung. Die Thiazolgruppe wird also z.B. gegen eine Pyridin-Gruppe ausgetauscht (Abb. 8).
 |
| Abb. 8: Thiamin |
Thiaminase 2 katalysiert die einfache Hydrolyse des Thiamins zum Pyrimidin- und Thiazol-Anteil (7).
Thiaminase 2 findet sich vor allem in Bakterien, Thiaminase 1 im Schellfisch, in Frischwasserfischen sowie in manchen anderen Meeresfischen und einigen Pflanzen, z.B. im Farn und im Ackerschachtelhalm (Equisetum arvense). Thiaminase 1 wurde auch aus Pansen und Faeces von Tieren mit Polioenzephalomalazie gewonnen. Die Polioenzephalomalazie, auch Sterngucker-Krankheit bei Rindern bezeichnet, da die Schädelweiche mit einer Überstreckung der Nackenmuskulatur einhergeht, wird durch sekundär-nutritive Ursachen hervorgerufen – Veränderung der Bakterienflora oder Verfütterung Fischmehl- und Thiaminase-haltiger Nahrungsmittel.
Niedermolekulare thermostabile Pflanzenbestandteile
Farnextrakte enthalten zwei thermostabile Antithiamin-Faktoren. Somogyi konnte einen Antithiaminfaktor in kristalliner Form pur isolieren und als 3,4-Dihydroxyzimtsäure (Kaffeesäure) identifizieren. Andere o-Diphenole hatten in vitro ebenfalls einen ausgeprägten thiaminantagonistischen Effekt. Diese Beobachtungen sind aber umstritten und konnten nicht von allen Untersuchern bestätigt werden.
Pflanzen mit möglichem Antithiaminwirkungspotenzial:
Heidelbeere, rote Zichorie, rote Johannisbeere, rote Runkelrübe, Kohlsprossen und Rotkraut.
Alkohol
Während Vitamin-B1-Defizite in den Entwicklungs- und Schwellenländern meist Folge von Unterernährung sind, ist ein Thiaminmangel in den Industrienationen in erster Linie bei Alkoholabusus zu finden.
Die bei Alkoholikern sehr häufigen neurologischen und kardiovaskulären Erkrankungen können auch als typische Thiaminmangel-Symptome interpretiert werden. Alkoholmissbrauch führt zu einer gestörten Thiaminresorption im Darm und verminderter Speicherung in der Leber. Der Metabolit Acetaldehyd blockiert die thiaminabhängige Pyruvat-dehydrogenase und damit die oxidative Decarboxylierung von 2-Oxosäuren. Folge ist eine Kumulation von Pyruvat und Lactat und verminderte Bildung von Acetyl-CoA. Thiamindefizite führen zur perniziösen Beriberi mit stark erhöhtem Milchsäurespiegel in Blut und Hirn, oftmals mit tödlichem Ausgang. Die trockene Beriberi äußert sich mit neuronalen Störungen (Polyneuropathie), Augenmuskellähmungen, Psychosen und schweren Gedächtnisstörungen. Die feuchte Beriberi ist gekennzeichnet durch Ödeme und Herzkrankheiten.
Tee und Betelnuss
In vielen Provinzen Thailands gibt es einen ausgeprägten Thiaminmangel, der durch Kauen von Teeblättern und Betelnuss sowie – wie bereits erwähnt – durch Verzehr von rohem fermentiertem Fisch hervorgerufen wird. Durch Entzug der Teeblätter und durch Kochen der Fischnahrung, wodurch die Antithiamine inaktiviert wurden, konnte der Thiaminmangel effektiver aufgehoben werden als durch die Gabe von 10 mg Thiamin/Tag. Für die Antithiaminwirkung im Tee wird Tannin verantwortlich gemacht, das mit Thiamin einen Komplex bildet.
Biotin (Vitamin H)
Biotin ist in Nahrungs- und Futtermitteln weit verbreitet und wird auch durch die intestinale Mikroflora gebildet. Ein Mangel ist sehr selten, es sei denn, Antagonisten werden zugeführt.
Avidin
Die Beobachtung, dass das Verfüttern von Eiklar an Ratten zu Dermatitis und Haarverlust führt und dadurch Gabe von Biotin heilbar ist, führte zur Isolierung von Avidin aus Eiklar. Avidin bildet mit Biotin einen stabilen Komplex, der im Darm nicht resorbiert wird.
Diese Beobachtung wurde in der Folge zur Erforschung von Symptomen eines Biotinmangels genützt.
Nach vier Wochen Avidin-induzierten Biotinmangels zeigten sich Depressionen, extreme Mattigkeit, Halluzinationen, Muskelschmerz und Hyperästhesie. Nach weiteren zwei Wochen wurde die Haut grauweiß und schuppig.
Avidin kann durch Hitzeeinwirkung inaktiviert werden. Der Avidin-Biotin-Komplex vertritt die stärkste der bisher in der Natur bekannten nicht-kovalenten Bindungen (8).
Die klassischen Symptome eines durch Eiklar verursachten Biotinmangels sind Dermatitis, Glossitis, Anorexie (Appetitlosigkeit), Übelkeit, Sitophobie (Nahrungsverweigerung) und Depressionen.
Oxybiotin weist 4% der biologischen Aktivität des Biotins auf.
Norbiotin, Dehydrobiotin, Biotinsulfon, Desthiobiotin und Homobiotin sind vollständige Biotinantagonisten (9): Dehydrobiotin wurde 1966 aus Streptomyces lydicus isoliert. Es hemmt das Wachstum vieler Bakterien wie E. Coli und Bacillus subtilis (8).
5-(2-Thienyl)valeriansäure ist ein Biotinanalogon, das das Wachstum vieler Bakterien, Aktinomyceten und Schimmelpilze hemmt.
Acidomycin ist ebenfalls ein Antibiotikum, das gegen Mykobakterien (Tuberkelbazillen) aktiv ist, indem es deren Biotinsynthese blockiert. Acidomycin ist ein kompetitiver Inhibitor einer bakteriellen Biosynthese von Biotin aus Desthiobiotin (8).
Niacin: Nicotinsäure, Nicotinamid
Pellagra (»rauhe Haut«) ist eine Niacinmangelerkrankung, die sich als Hautveränderung in Form von Schuppungen und Lichtempfindlichkeit, als Veränderung der Schleimhaut des Mundes, der Zunge, des Magens und des Intestinaltraktes sowie in Veränderung nervöser Art manifestiert. Die Hautläsionen erinnern am Anfang an einen Sonnenbrand. Die Symptome treten an Körperstellen auf, die dem Sonnenlicht ausgesetzt sind.
Pellagroide Symptome zeigen sich beim Hartnup-Syndrom, einer autosomal rezessiv erblichen Stoffwechselerkrankung, die charakterisiert ist durch eine Resorptionsstörung von Tryptophan im Darm und der tubulären Rückresorption neutraler Aminosäuren (10) (Abb. 9).
 |
| Abb. 9: Tryptophanabbau durch Vitamin B6-abhängige Enzyme |
Mais/Jowar und Sorghum
Die Einfuhr von Mais aus Amerika nach Spanien durch Kolumbus brachte die Pellagra mit, die man zunächst für eine spezielle Form der Lepra hielt. Heute ist die Pellagra unter der schwarzen Bevölkerung Südafrikas, in Ägypten sowie in Indien verbreitet. Sie tritt meist da auf, wo viel Mais und Sorghum (Hirse), aber wenig Fleisch verzehrt wird. Ursprünglich wurde das Fehlen von Nicotinsäure (s.o.) in Mais und Sorghum für das Auftreten der Pellagra verantwortlich gemacht. Reis enthält allerdings weitaus weniger Nicotinsäure und ruft keine Pellagra hervor. Nutritive Tryptophandefizite durch einseitige Ernährung wurden in der Folge als Auslöser diskutiert. Tryptophan liefert über den Tryptophanabbau unter anderem die Chinolinsäure, die als Vorstufe der körpereigenen Nikotinsäurebiosynthese fungiert. In jüngerer Zeit häufen sich Befunde, in denen Leucin als Auslöser pellagroider Symptome gesehen wird. Leucingehalt und pellagroide Effekte von Getreidearten korrelieren stark.
|
|
|
|
| . |
Nicotinsäure |
Tryptophan |
Leucin |
|
|
|
|
| Reis |
1,2 |
1,2 |
8,0 |
| Weizen |
5,5 |
1,1 |
6,5 |
| Mais |
1,4 |
0,8 |
14,9 |
| Jowar (Sorghum) |
1,8 |
1,2 |
12,9 |
|
|
|
|
| Gehalt in g/100 g Protein einiger Getreidearten an Nicotinsäure, Tryptophan und Leucin |
|
Bei Pellagra-Patienten wurde eine vermehrte Ausscheidung von Chinolinsäure beobachtet, was in Übereinstimmung steht mit der Hemmung der Chinolinat-Phospho-Ribosyltransferase, die die Synthese von Nikotinsäure aus Chinolinsäure katalysiert. Andere Theorien sehen eine Hemmung der Resorption von Tryptophan durch Leucin als Ursache für das Auftreten von Pellagra bei einseitiger Ernährung mit Mais und Sorghum.
Riboflavin
Ackee Nut (Hypoglycin)
Die in Jamaika vorkommende »Ackee Nut« (Blighia sapida) kann in unreifem Zustand, besonders nach Verzehr bei Eingeborenenkindern, zu starkem Erbrechen führen. Die Erkrankung tritt besonders zu kühlen und trockenen Jahreszeiten auf und hat einen dramatischen, in 80% tödlichen Verlauf. Die Frucht besitzt zwei toxische Substanzen: Hypoglycin A und B (Beta-Methylencyclopropylalanin und Glutamyl-Beta-Methylencyclopropan). Hypoglycine hemmen die Gluconeogenese ausgehend vom Pyruvat mit einer raschen Entleerung der Glykogenreserven in der Leber. Folge ist ein rapider Abfall des Blutzuckerspiegels auf unter 20–22 mg/100 ml mit komatösen Zuständen. Die toxischen Symptome der Ackee-Nuss-Vergiftung können antagonisiert bzw. vermieden werden durch parenterale Gabe von Riboflavin. Die stimulierenden Effekte von Riboflavin auf den Kohlenhydratstoffwechsel, besonders auf die Gluconeogenese, unterstützen diese Theorie (11).
Roseoflavin
Roseoflavin ist ein Antibiotikum, das aus Streptomyces davawensis gewonnen wird. Es ist ein Riboflavinantagonist und wirkt antibiotisch auf Staphylococcus aureus (8).
Vitamin K
Dicumarol
1922 wurde erstmals über ein Viehsterben in Nordamerika berichtet, das durch starke Blutungen der Tiere verursacht wurde. 1930 konnte die Hämorrhagie auf einen Prothrombinmangel im Blut zurückgeführt werden, der durch ein Cumarin-Derivat, das Dicumarol ausgelöst wird. Dicumarol wird in verdorbenem Süßklee produziert. Cumarine greifen in den Vitamin K-Stoffwechsel ein, indem sie die Vitamin K-Epoxid-Reduktase und die Vitamin K-Reduktase hemmen und damit die Biosynthese der Gerinnungsfaktoren 2, 7, 9 und 10.
Lapachol (Abb. 10), ein substituiertes 1,4-Naphtochinon, ist Bestandteil der Samen einiger tropischer Pflanzen und ebenfalls ein starker Inhibitor der Vitamin K-Reduktase. Lapachol wirkt als Antikoagulans bei Ratten und Menschen. Lapachol wurde in der Pflanzenfamilie der Bignoniaceae (z.B. Palisander und andere Harthölzer) und Verbenaceae als hautirritierendes Prinzip nachgewiesen (3).
 |
| Abb. 10: Vitamin K-Zyklus. Cumarinderivate inhibieren die Schritte 1 und 3, Chlor-K inhibiert den Schritt 2. KH2 steht für Vitamin K-Hydrochinon, KO für Vitamin K-2,3-Epoxid |
Vitamin A/E
Vitamin A und E wirken antagonistisch gegenüber Vitamin K. Besonders Hypervitaminosen A führen zu Nasenbluten und Hämorrhagien, die durch Vitamin K-Gabe antagonisiert werden können. Megadosen Vitamin E führen zu einer beträchtlichen Abnahme der Aktivität der Koagulationsfaktoren. Als Ursache wird eine Strukturanalogie sowie ein konkurrierender Effekt bei der Resorption diskutiert.
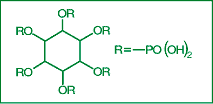 |
|
Abb. 11: Phytinsäure
|
Interaktionen von Zinkkomplexbildnern mit Folsäure, Vitamin B6 und Vitamin A
Phytate (Inositolhexaphosphate) können Zink binden und die Aufnahme hemmen. Phytate kommen in hohen Konzentrationen im Brot vor, das mit hochextrahierten Weizenmehlen gebacken ist (Abb. 11).
Schwarzer Tee und Weizenkleie (bis zu 3%) enthalten ebenfalls Phytate, Coca-Cola Phosphatverbindungen.
Alkohol: Chronischer Alkoholkonsum führt ebenfalls zu Zinkdefiziten.
Folge der Zinkdefizite ist eine reduzierte Bioverfügbarkeit der Vitamine A und B6 sowie der Folsäure, da Zink Cofaktor der alkalischen Phosphate und der Folsäuredekonjugase ist, die die Nahrungsvitamine aus ihren Vorstufen in resorbierbare Substrate transformiert. Zink aktiviert die Biosynthese des Retinolbindungsproteins und verbessert den Transport von Vitamin A aus den Leberspeichern in die Peripherie und ins ZNS. Die Biosynthese von Retinaldehyd und Retinsäure aus Retinol erfolgt über die zinkabhängige Alkoholdehydrogenase.
Literatur:
1 Toth, B.; Erickson, J.; Reversal of the toxicity of Hydrazine-Analogues by Pyridoxine hydrochloride. Toxicology 7 (1977) 31–36
2 Seeger, R.; Vergiftungen durch höhere Pilze. DAZ 135 (1995) 3371
3 Frohne, D.; Böhme, E.; Systematik des Pflanzenreiches. Gustav Fischer Verlag (1973) S. 141
4 Schmidt, H.; Böhme, E.; NO, ein hormonaler Wirkstoff. Med Mo Pharm 13 (1990), 78
5 Bell, E. A.; Canavanine in the Leguminoses. Biochem J 75 (1960) 618–20
6 Malinov, M. R.; Systemic Lupus eryth. like syndrome in monkeys fed with Alfalfa spread. Science
7 Edwin, E. E.; Determination of Thiaminase activity using Thiazole labeled Thiamin. Methods of Enzymology 62 (1979) 113–8
8 Friedrich, W.; Handbuch der Vitamine. Urban & Schwarzenberg Verlag München 1986, S. 513
9 Bitsch, R.; Bartel, K.; Biotin. Wissenschaftliche Verlagsgesellschaft Stuttgart 1994, S. 16
10 Bielenberg, J.; Das Hartnup-Syndrom. Med. Mo. Pharm 16 (1993) 183–6
11 Foy, H.; Riboflavin. Prg Fd. Nutr. Sci 2 (1977) 357–94
Empfohlene Literatur:
Jens Bielenberg: Vitamin C, Reglin-Verlag, Köln 2001, Euro 10,80; Arzneimittel und Vitamine, Govi Verlag, Eschborn 1995, Euro 20,60
Anschrift des Verfassers:
Apotheker Jens Bielenberg, Raphael-Apotheke, Bahnhofstr. 53, D-25364 Westerhorn
|
|
|
Besuchen Sie uns auch unter www.apoverlag.at
|
|










